|
|
Категория:
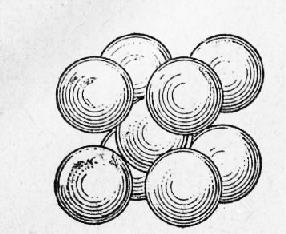
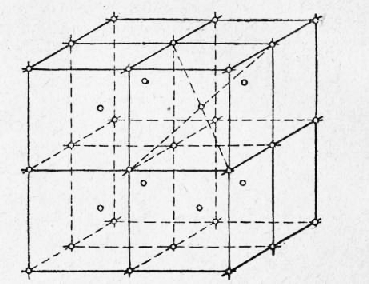
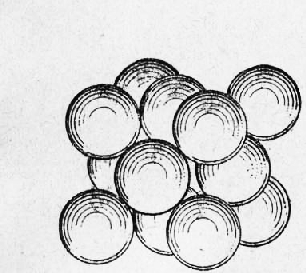
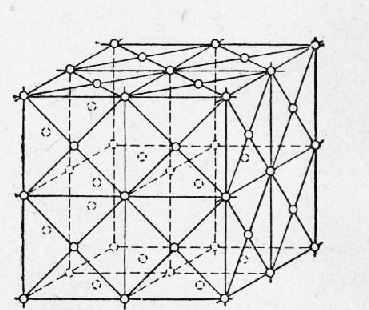
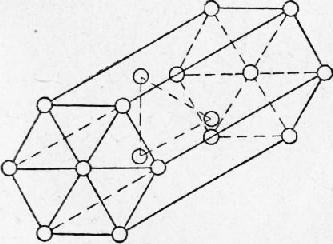
Металлы Далее: Основные свойства металлов Все вещества в твердом состоянии имеют кристаллическое или аморфное строение. В аморфном веществе (стекле, канифоли) атомы расположены хаотично, без всякой системы. В кристаллическом веществе атомы расположены по геометрически правильной схеме и на определенном расстоянии друг от друга. Все металлы исплавы имеют кристаллическое строение. Кристаллические зерна имеют неопределенную форму и внешне не похожи на типичные кристаллы — многогранники, поэтому их называют кристаллитами, зернами или гранулями. Однако внутреннее строение кристаллитов ничем не отличается от внутреннего строения кристаллов. Виды кристаллических решеток. При затвердевании атомы металлов образуют геометрически правильные системы, называемые кристаллическими решетками, Порядок расположения атомов в решетке может быть различным, ехнич. ские металлы образуют решетки, простейшие (элементарные; ячейки которых представляют центрированный куб [а- и б-железо, хром, молибден, вольфрам, ванадий, марганец], куб с центрированными гранями [у-железо, алюминий, медь, никель, свинец или гексагональную, имеющую форму шестигранной призмы ячейку (магний, цинк, а-титан, а-кобальт). Элементарная ячейка повторяется в трех измерениях, образуя кристаллическую решетку, поэтому положение атомов в элементарной ячейке определяет структуру всего кристалла. Элементарная ячейка центрированного куба (рис. 1) состоит из девяти атомов, из которых восемь расположены по вершинам куба, а девятый — в его центре. Для характеристики кристаллической решетки (атомной структуры кристалла) применяют пространственную решетку, которая является геометрической схемой кристаллической решетки и состоит из точек (узлов), закономерно расположенных в пространстве. На рис. 2 приведена часть пространственной решетки центрированного куба. Здесь взяты восемь смежных элементарных ячеек; узлы, расположенные по вершинам и в центре каждой ячейки, отмечены кружками. Элементарная ячейка куба с центрированными гранями (рис. 3) состоит из 14 атомов, из них 8 атомов расположены по вершинам куба и 6 атомов — по граням. На рис. 4 приведена часть пространственной решетки куба с центрированными гранями (гранецентрированного куба). На схеме имеется восемь элементарных ячеек: узлы расположены по вершинам и по центрам граней каждой ячейки. Гексагональная ячейка состоит из 17 атомов, из них 12 атомов расположены по вершинам шестигранной призмы, 2 атома — в центре основания и 3 атома — внутри призмы. Для измерения расстояния ‘между соседними атомами кристаллических решеток пользуются специальной единицей, называемой ангстремом (А); А = 10~8 см. Параметр решеток (сторона куба или шестигранника) у меди 3,6А, а у алюминия 4,05 А, у цинка 2,67 А и т. д. Каждый атом состоит из положительно заряженного ядра и нескольких слоев (оболочек) отрицательно заряженных и движущихся вокруг ядра электронов. Электроны внешних оболочек атомов металлов, называемые валентными, легко отщепляются, быстро движутся между ядрами и называются свободными. Вследствие наличия свободных электронов атомы металлов являются положительно заряженными ионами. Таким образом, в узлах решеток, обозначенных кружками на рис. 2 и 4, находятся положительно заряженные ионы. Ионы, однако, не находятся в покое, а непрерывно колеблются около положения равновесия. С повышением температуры амплитуда колебаний увеличивается, что вызывает расширение кристаллов, а при температуре плавления колебания частиц усиливаются настолько, что это приводит к разрушению кристаллической решетки.
Рис. 1. Элементарная ячейка центрированного куба
Рис. 2. Часть пространственной решетки центрированного куба
Рис. 3. Элементарная ячейка куба с центрированными гранями
Рис. 4. Часть пространственной решетки куба с центрированными гранями
Рис. 5. Гексагональная ячейка
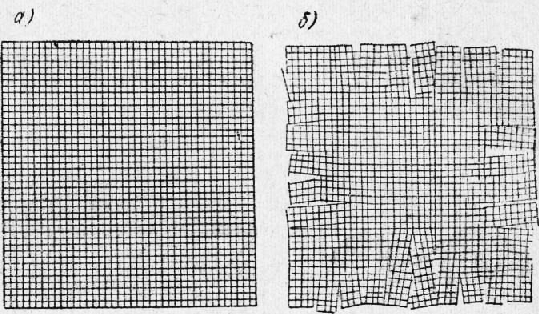
Во всех кристаллах наблюдаются небольшие отклонения от идеальной решетки — незанятые узлы и различного рода смещения атомов. На рис. 34 приведены схемы строения идеальной и реальной кристаллических решеток. Анизотропность и спайность кристаллов,. В отдельных кристаллах свойства различны в разных направлениях. Если взять большой кристалл, вырезать из него несколько одинаковых по размеру, но различно ориентированных образцов, и произвести испытания их, то иногда можно получить весьма значительную разницу в свойствах между отдельными образцами. Например, при испытании образцов, вырезанных из кристалла меди, величина удлинения изменялась в пределах от 10 до 55%, а величина предела прочности — от 14 до 35 кг!мм2 для различных образцов. Это свойство кристаллов называют анизотропностью. Анизотропность кристаллов объясняется определенным расположением атомов в пространстве.
Рис. 6. Схема строения идеальных (а) и реальных (б) кристаллов
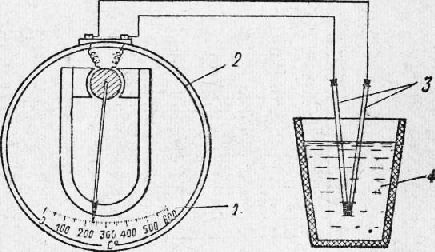
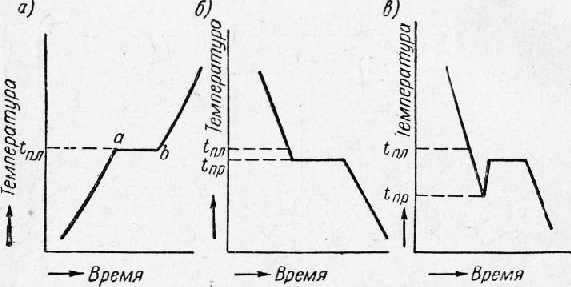
Следствием анизотропности кристаллов является спайность, которая выявляется при разрушении. В местах излома кристаллов можно наблюдать правильные плоскости, указывающие на то, что смещение частиц под влиянием внешних сил происходит не беспорядочно, а правильными рядами, в определенном направлении, соответственно расположению частиц в кристалле. Эти плоскости называются плоскостями спайности. Аморфные тела изотропны, т. е. все их свойства одинаковы во всех направлениях. Излом аморфного тела всегда имеет неправильную, искривленную, так называемую раковистую поверхность. Металлы, затвердевшие в обычных условиях, состоят не из одного кристалла, а из большого количества отдельных кристаллов, различно ориентированных по отношению друг к другу, поэтому свойства литого металла будут приблизительно одинаковы во всех направлениях; это явление называют квазиизотропностью (кажущейся изотропностью). Аллотропия металлов. Аллотропией (или полиморфизмом) металлов называется их свойство иметь различное строение при различных температурах. Аллотропию обнаруживают все элементы, имеющие валентность, меняющуюся при изменении температуры: например, железо, марганец, никель, олово и др. Каждое аллотропическое превращение происходит при определенной температуре. Например, одно из превращений железа протекает при температуре 910°, ниже которой атомы составляют решетку центрированного куба, а выше — решетку гранецентрированного куба. Та или иная структура называется аллотропической формой или модификацией. Различные модификации обозначают греческими буквами а, (3, у и т. д. в виде индексов, причем букву а приписывают модификации, существующей при темперах-турах ниже первого аллотропического превращения. Аллотропические превращения сопровождаются выделением или поглощением теплоты. Кристаллизация металлов. Кристаллизацией металлов называется образование кристаллов в металлах (и сплавах) при переходе из жидкого состояния в твердое (первичная кристаллизация). Перекристаллизацию из одной модификации в другую в процессе охлаждения затвердевшего металла называют вторичной кристаллизацией. Процесс кристаллизации металла легче всего проследить с помощью счетчика времени и термоэлектрического пирометра, который представляет милливольтметр 2, подключенный к термопаре. Термопару (две разнородные проволоки, спаянные концами) погружают в расплавленный металл. Возникающий при этом термоток пропорционален температуре металла, и стрелка милливольтметра отклоняется, указывая эту температуру по специально градуированной шкале. Показания пирометра записывают во времени и по полученным данным строят кривые охлаждения в координатах температура —время. Температура, соответствующая какому-либо превращению в металле, называется критической точкой. На рис. 8,а приведена кривая, полученная при нагревании металла. Здесь горизонтальный участок (площадка ab) указывает место критической точки плавления tnjl. Точка а соответствует началу плавления, точка b — окончанию плавления.
Рис. 7. Схема изменения температуры металла термоэлектрическим пирометром
Участок ab характеризует неизменность температуры во времени при продолжающемся нагреве. Это показывает, что тепловая энергия затрачивается на внутреннее превращение в металле, в данном случае на превращение твердого металла в жидкий (скрытая теплота плавления). При охлаждении переход из жидкого состояния в твердое сопровождается образованием кристаллической решетки, т. е. кристаллизацией.
Рис. 8. Кривые нагревания (а) и охлаждения (б — без петли, в — с петлей) металла
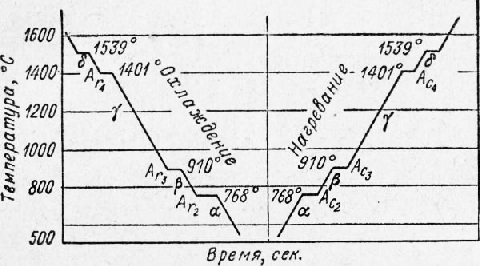
У некоторых металлов величина переохлаждения (tnx — tnp) оказывается весьма значительной (у сурьмы, например, до 40°), и при температуре переохлаждения tnp сразу бурно начинается кристаллизация, в результате чего температура скачкообразно повышается почти до tnjl. В этом случае на графике образуется петля теплового гистерез иса. При затвердевании и при аллотропическом превращении в металле вначале образуются центры кристаллизации, вокруг которых группируются атомы, образуя соответствующую кристаллическую решетку. Таким образом, процесс кристаллизации, складывается из двух этапов: образования центров кристаллизации и роста кристаллов. У каждого из возникающих кристаллов кристаллографические плоскости ориентированы случайно, кроме того, при первичной кристаллизации кристаллы могут поворачиваться, так как они окружены жидкостью. Смежные кристаллы растут навстречу друг другу и точки их столкновения определяют границы кристаллитов (зерен). У аморфных веществ кривые охлаждения плавные, без площадок и уступов; понятно, что аллотропии у этих веществ быть не может. Кристаллизация железа. Рассмотрим в качестве примера процесс кристаллизации и критические точки железа, важнейшего технического металла. На рис. 9 приведены кривые охлаждения и нагревания чистого железа. Железо плавится при температуре 1539°. Наличие критических точек при более низких температурах указывает на то, что железо имеет несколько аллотропических видоизменений в твердом состоянии. Критические точки превращений железа обозначают буквой А, приписывая букву с — при нагревании и букву г — при охлаждении; индексы 2, 3 и 4 служат для отличия аллотропических превращений друг от друга (индекс 1 резервирован для обозначения превращений на диаграмме состояния Fe—Fe3C.
Рис. 9. Кривые охлаждения и нагревания железа
При температурах ниже 768° железо обладает магнитными свойствами и имеет кристаллическую решетку центрированного куба. Эта модификация носит название а-железо: при нагревании она в точке Асг переходит в немагнитную модификацию Р-железо. Кристаллическая структура при этом не меняется (по современным представлениям магнитное превращение связано с изменениями во внешних электронных оболочках атомов), поэтому р-железо называют также немагнитным а-железом. В точке Ас3 при температуре 910° Р-железо (немагнитное а-железо) переходит в у-железо, имеющее кристаллическую решетку гранецен-трированного куба. В точке Ас4 при температуре 1401° у-железо переходит в б-железо, причем кристаллическая решетка вновь перестраивается из гранецен-трированного куба в центрированный куб. При охлаждении будут иметь место те же переходы, только в обратной последовательности. Из перечисленных превращений наибольшее практическое значение имеют превращения в точке А3 как при нагреве, так и при охлаждении. у-железо способно растворить до 2% углерода при температуре 1130°; а-железо — до 0,025% при 723° и лишь 0,006% при 0°. Свойство у-железа растворять значительное количество углерода используется для производства ряда операций термической и химико-термической обработки. Превращение в точке А3 связано с изменением объема, так как плотность кристаллической решетки у-железа больше плотности решетки а-железа. Реклама:Читать далее:Основные свойства металловСтатьи по теме:Главная → Справочник → Статьи → Блог → Форум |
|
|
|
|
Контакты: Сергей Королёв © 2007-2009 Pereosnastka.ru - информационный сайт о металло- и деревообработке. |
© Все права защищены.
Копирование материалов невозможно. |
|