|
|
Категория:
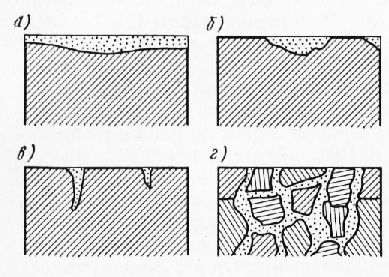
Промышленные материалы Далее: Виды коррозионных разрушений Коррозией называется разрушение металла вследствие химического или электрохимического взаимодействия его с окружающей средой. Коррозии подвержены все металлы, но в зависимости от условий эксплуатации, хранения и транспортирования протекает она по-разному. Примерно около 10% выплавляемых черных металлов ежегодно теряются в виде коррозионной пыли. Первоначальная стадия коррозии выражается в потускнении поверхности металла, появлении на изделиях темных точек или участков, окрашенных в другой цвет, например медь становится зеленоватой. Коррозию классифицируют по механизму разрушения (окисления), виду агрессивной среды, характеру разрушения. В зависимости от механизма разрушения коррозию подразделяют на химическую и электрохимическую. Химическая коррозия характеризуется только окислительными процессами. Протекает она в неэлектролитах — бензине, керосине, сухих газах. Этот вид коррозии часто наблюдается при высоких температурах. При комнатной температуре металлы также окисляются с образованием на поверхности оксидной пленки, которая препятствует проникновению агрессивных элементов вглубь. Электрохимическая коррозия в отличие от химической характеризуется наличием окислительных и восстановительных процессов при протекании электрического тока. Она является наиболее распространенной и сложной. К ней относится коррозия в атмосферных условиях, в морской и речной воде, в электролитах. По виду агрессивной среды коррозию подразделяют на атмосферную, морскую и речную, почвенную, коррозию в электролитах и др. Атмосферная коррозия является наиболее распространенной, на ее долю приходится около 80% всех коррозионных разрушений. Атмосферную коррозию подразделяют по виду атмосферы и по виду климата. По виду атмосферы ее делят на промышленную, сельскую, приморскую и др. Наиболее агрессивной является приморско-про-мышленная среда, так как в ней наряду с высокой влажностью частыми туманами находятся и различные газы (сернистые, серные, оксиды углерода и др.), поступающие с промышленных предприятий. По виду климата атмосферную коррозию подразделяют на коррозию в умеренном и коррозию в тропическом климате. Последняя значительно сильнее действует на металл, так как кроме высокой влажности влияет температура, солнечная радиация и другие факторы. Морской и речной коррозией называют разрушение металла соответственно в морской или речной воде, например разрушение корпусов, гребных винтов морских и речных судов, лодок и т. п. Почвенная коррозия вызывает коррозию металлов в почве, например, водопроводных, газовых или других металлических труб, свай, находящихся в земле. Коррозией в электролитах называется разрушение металла в водных растворах кислот, щелочей и солей. Этот вид коррозии встречается при травлении металлов, в химической промышленности. По характеру разрушения металла коррозию подразделяют на четыре вида (рис. 1). Защита металлов от коррозии. Для защиты металлов от коррозии применяют следующие методы: повышение коррозионной стойкости металлов, снижение агрессивности среды, отделение металла от агрессивной среды- Повышение коррозионной стойкости металлов осуществляют легированием, удалением из металлов вредных примесей (очистка), модифицированием, химико-термической обработкой.
Рис. 1. Виды коррозии: а —сплошная; б — местная; в—язвенная; г — межкристаллитная
Для снижения агрессивности среды уменьшают концентрацию агрессивных газов, удаляют влагу, пыль и другие загрязнения. Эти способы особенно эффективны при хранении металлоизделий на складах и при их транспортировании. Для этой цели в складских помещениях поддерживают постоянную температуру и влажность, помещения хорошо проветриваются. Кроме того, применяют ингибиторную защиту, т. е. в агрессивную среду вводят вещества, уменьшающие степень ее коррозионной агрессивности, называемые ингибиторами. Чаще всего ингибиторы вводят в смазки. Защиту металлов от коррозии, связанную с их отделением от агрессивной среды, осуществляют нанесением металлических и неметаллических покрытий, смазочных масел (индустриальные масла). По способу нанесения металлические покрытия подразделяют на гальванические и нанесенные горячим методом. Для гальванических покрытий характерна пористость. Поэтому их наносят на предварительно нанесенные слои других металлов. Например, при покрытии металла никелем в качестве подслойного материала применяют медь. Сущность гальванического метода заключается в осаждении металла из раствора солей на изделии при пропускании через раствор электрического тока. При горячем методе готовое изделие опускают на несколько секунд в расплавленный металл, предназначенный для нанесения покрытий. Этим методом наносят покрытия из легкоплавких металлов. В качестве неметаллических покрытий для защиты от коррозии применяют лакокрасочные, силикатные, полимерные и другие покрытия. Защищают металл и путем создания оксидных пленок на его поверхности — оксидированием. — Коррозией называется процесс разрушения металлов и сплавов под воздействием внешней среды. Типичными примерами коррозии является ржавление стали, разъедание подводных частей судов морской водой, разрушение деталей химической Аппаратуры под влиянием растворов солей и кислот, от действия высокой температуры и т. д. Известно, что от коррозии ежегодно пропадает до 10% всех добываемых металлов. Это огромные потери, и борьба с ними приобретает серьезное значение. Для борьбы с коррозией применяют следующие способы: Оксидирование — нагрев стального изделия и охлаждение-в минеральном масле. На поверхности стали образуется тонкая пленка окисла черного цвета, защищающая ее от ржавления. Такое покрытие называется оксидированием или воронением стали. Оксидирование часто применяется для покрытия оружия: пистолетов, охотничьих ружей и т. п. При сухом воронении стальные изделия покрывают тонким слоем асфальтового лака и выдерживают в течение 10—20 минут в печи при температуре 300—450°. Поверхность изделия приобретает блестящий синий или черный цвет. Легирование — процесс сплавления стали с другими металлами, значительно улучшающими ее свойства. Коррозионная стойкость стали возрастает, если в ее состав входят не поддающиеся окислению на воздухе металлы. Таким путем получают нержавеющую сталь, в которой легирующими элементами являются хром (12—18%) или никель (4—8%). Металлическое покрытие. В целях экономии стойких от коррозии металлов ими покрывают металлические изделия только поверхностным тонким слоем. Для покрытия стальных изделий широко применяются цинк (оцинкованное железо) и олово (луженая жесть). Это покрытие осуществляется погружением деталей с тщательно очищенной поверхностью в расплавленный металл или гальваническим способом с помощью постоянного электрического тока (никелирование, хромирование). Окраска. Самый простой и распространенный способ предохранения металлов от коррозии — это покрытие их красками, лаками и эмалями. После высыхания растворителя изделие оказывается защищенным слоем краски или эмали, который, кроме защиты от коррозии, придает металлу желаемый цвет. Смазка. Предохранение металлических изделий от коррозии хорошо осуществляет слой густого масла, которое выполняет эту роль так же, как краски, но в отличие от них легко может быть Удалено в случае необходимости. Смазка маслом широко применяется для защиты от коррозии станков, инструментов, оружия, особенно в период их храпения (консервация). — Коррозией называется непроизвольное разрушение металлов и сплавов под действием окружающей среды. Коррозия называется химической, если она происходит под действием сухих газов или жидкостей-неэлектролитов, т. е. жидкостей, не проводящих электрический ток (бензин, керосин, смола и т. п.). Коррозия называется электрохимической, если она происходит при взаимодействии с жидкостями-электролитами, т. е. проводящими электрический ток (вода, пар, водяные растворы солей, щелочи, кислоты и т. п.). Так как в подавляющем большинстве случаев металлические детали работают в условиях влажной атмосферы или газов, а некоторые детали, например в подводных лодках, пароходах и гидросамолетах, при непосредственном контакте с растворами солей (морская вода), то явление коррозии может наблюдаться на них в сильной степени, если не будут приняты меры, замедляющие скорость коррозии или устраняющие ее вовсе. Статистические данные показывают, что количество металлов и сплавов, пришедших в негодность от коррозии, составляет около 40% от общего количества выплавленных металлов и сплавов. Мировые потери от коррозии за время с 1890 по 1923 г. выражаются огромной цифрой — 706 млн. т из 1760 млн. т общего количества чугуна и стали, выплавленных за тот же период. При химической коррозии металл или сплав, взаимодействуя с газами при высоких температурах или с жидкостями-неэлектролитами, образует различные химические соединения (оксиды, сульфиды, и др.), т. е. разрушается, переходя в неметаллическое состояние. При электрохимической коррозии металл или сплав, взаимодействуя с электролитом, переходит в раствор в виде положительно заряженных частиц (ионов). Происходящие здесь процессы напоминают действие простейшего гальванического элемента. Если такой элемент состоит из пластинки цинка, опущенной в раствор сернокислого цинка, и пластинки меди, опущенной в раствор сернокислой меди, то при замыкании этих пластинок возникает электрический ток и электроны начинают перемещаться от цинковой пластинки к медной. Это значит, что у цинка большая способность превращаться в положительно заряженные частицы (ионы). В силу этих причин цинковая пластинка в гальваническом элементе в процессе работы будет разрушаться. Образование микрогальванических элементов вследствие неоднородности структуры при взаимодействии металлов и сплавов с жидкостями-электролитами и составляет сущность процесса электрохимической коррозии. Реклама:Читать далее:Виды коррозионных разрушенийСтатьи по теме:Главная → Справочник → Статьи → Блог → Форум |
|
|
|
|
Контакты: Сергей Королёв © 2007-2009 Pereosnastka.ru - информационный сайт о металло- и деревообработке. |
© Все права защищены.
Копирование материалов невозможно. |
|