|
|
Категория:
Цветные металлы Далее: Схема коррозионного процесса Работа гальванических элементов и процесс электрохимической коррозии зависят от величины электрохимических, или электродных потенциалов, возникающих на границе металл — электролит. При погружении металла в электролит возможны два основных случая: 1. Энергия гидратации ионов Металла больше энергии, необходимой для преодоления потенциального барьера. При этом связи между ион-атомами и электронами разрываются, ионы металла переходят в электролит н гидратируются. Освобождающиеся электроны остаются в металле и сообщают ему отрицательный заряд, а переходящие в электролит ионы металла — положительный заряд электролиту. Этот процесс протекает до наступления равновесия между электронами и гидратированными ионами металла, устанавливающегося благодаря тому, что избыточные электроны на поверхности металла препятствуют дальнейшему выходу ион-атомов н избыточные ионы металла в электролите оказывают сопротивление переходу новых положительных ионов в раствор.
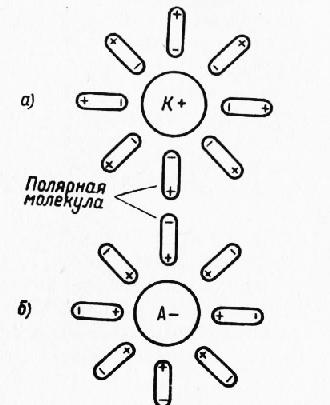
Рис. 1. Схема гидратации ионов:
а— катиона; б — аниона
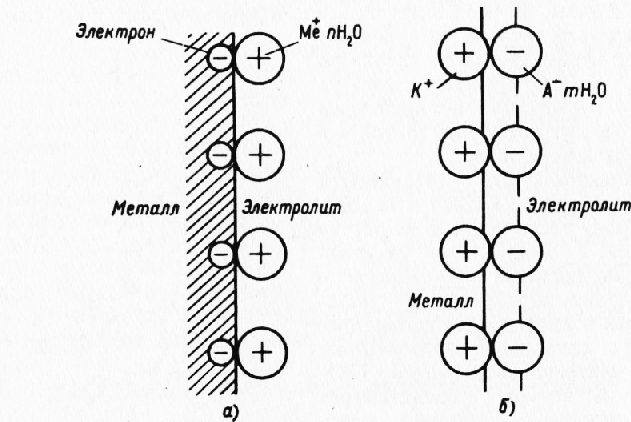
Рис. 2. Схема образования электродного потенциала:
а — отрицательного; б — положительного
В результате установившегося равновесия переход ионов в раствор прекращается, а разность зарядов двойного электрического слоя, возникшего на границе металл—электролит, определяет величину отрицательного электродного потенциала металла. Металлы, имеющие высокий отрицательный потенциал, легко корродируют (Mg, Zn, Cd, Fe и др.). 2. Энергия гидратации ионов металла меньше энергии, необходимой для преодоления потенциального барьера. Ионы металла в электролит не переходят. Наоборот, силы адсорбции ненасыщенного поверхностного слоя металла способствуют дегидратации катионов, находящихся в электролите. Катионы, адсорбируясь на поверхности металла, создают положительно заряженный слой, который притягивает оставшиеся в электролите избыточные анионы, располагающиеся в электролите у поверхности металла и создающие отрицательно заряженный слой. Таким образом на границе металл—электролит образуется двойной электрический слой и соответствующий ему скачок потенциала. Металл приобретает положительный заряд, а электролит — отрицательный. Разность зарядов определяет величину положительного электродного потенциала металла. Металлы, имеющие высокий положительный потенциал, хорошо противостоят коррозионному разрушению (Си и другие более электроположительные металлы). На величину и знак электродного потенциала оказывают влияние природа металла, свойства электролита и температура. При этом важное значение имеют строение и способность атома металла отдавать электроны, образуя ион-атомы, химический состав электролита, способность входящих в него компонентов диссоциировать на ионы, а также кислотность или щелочность электролита. Повышение температуры увеличивает степень диссоциации компонентов электролита и интенсифицирует процессы, протекающие на границе металл—электролит. Величина и знак электродных потенциалов различных металлов в данном электролите характеризует относительную стойкость их против коррозии. В соответствии с формулой Нернста равновесный потенциал металла зависит от логарифма концентрации одноименных ионов металла в электролите. Потенциалы равновесия между металлом и одноименными ионами называются обратимыми потенциалами. Обратимость заключается в том, что между металлом и раствором существует непрерывный обмен ионами, вследствие чего изменение концентрации ионов в электролите сместит равновесие. При этом, как следует из формулы Нернста, повышение концентрации ионов металла в электролите, препятствуя переходу новых ионов в раствор, вызывает увеличение равновесного потенциала; наоборот, понижение концентрации, облегчая переход новых ионов в раствор и тем самым увеличивая количество свободных электронов в металле, способствует уменьшению потенциала электрода. Ряд металлов: кадмий, ртуть, медь, серебро ведут себя в растворах собственных ионов при достаточно хорошем совпадении с формулой Нернста. Однако такие широкораспространенные металлы, как Fe, Al, Mg, совершенно не удовлетворяют уравнению Нернста. Кроме того, при низких концентрациях собственных ионов такие металлы, как Cd, также не подчиняются этой зависимости. Необходимо поэтому изучить условия возникновения и величину необратимых потенциалов, имеющих важное практическое значение. Реклама:Читать далее:Схема коррозионного процессаСтатьи по теме:Главная → Справочник → Статьи → Блог → Форум |
|
|
|
|
Контакты: Сергей Королёв © 2007-2009 Pereosnastka.ru - информационный сайт о металло- и деревообработке. |
© Все права защищены.
Копирование материалов невозможно. |
|