|
|
Категория:
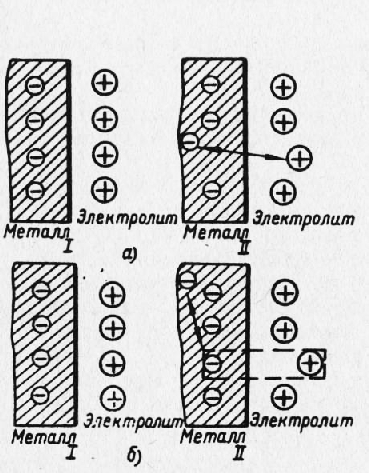
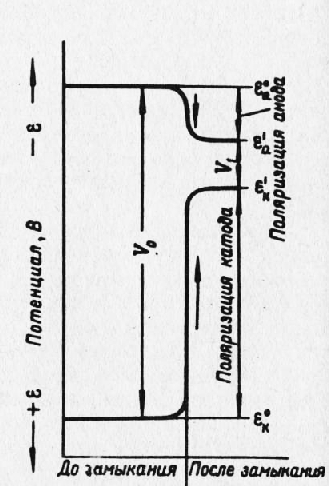
Цветные металлы Контакт разнородных металлов в конструкции (макропары) или фаз в сплаве (микропары) в присутствии электролита сопровождается процессом коррозии в результате работы гальванических пар. При этом металл с более положительным электродным потенциалом выполняет роль катода, а с более отрицательным— анода. Работа коррозионного гальванического элемента складывается из анодного процесса, перетекания электронов, катодного процесса и образования продуктов коррозии. 1. Анодный процесс состоит в переходе ионов металла в электролит, гидратации их и накоплении избытка электронов на аноде. 2. Перетекание электронов осуществляется по внешней цепи от анода к катоду, создает коррозионный электрический ток и обусловливает постепенное разрушение анода. 3. Катодный процесс заключается в восстановлении содержащихся в электролите катионов за счет электронов, которые перетекли с анода на катод, и в образовании у катода избытка гид-роксильных ионов. Этот процесс может протекать с водородной и с кислородной деполяризацией на катоде. 4. Образование продуктов коррозии в электролите происходит в результате соединения диффундирующих навстречу друг другу катионов металла от анода и гидроксильных ионов от катода. В результате процессов, протекающих на аноде и катоде при работе гальванического элемента с замкнутой внешней цепью, происходит изменение потенциала электродов, называемое поляризацией. Схемы поляризации анода и катода представлены на рис. 1. При анодной поляризации в результате ухода электронов во внешнюю цепь и далее к катоду потенциал анода становится менее отрицательным. При катодной поляризации в результате притока электронов потенциал катода становится менее положительным. Следовательно, замыкание внешней цепи и работа гальванического элемента сопровождаются поляризацией электродов, вызывающей существенное уменьшение разности потенциалов и снижение интенсивности коррозии. Однако во время работы коррозионной пары параллельно с поляризацией электродов протекает обратный процесс деполяризации, вновь увеличивающий разность потенциалов и вместе с нею интенсивность коррозии. Деполяризация анода вызывается понижением концентрации ионов металла в электролите у поверхности анода за счет диффузии. При этом облегчается переход ионов с анода в электролит и увеличивается количество электронов на аноде. Деполяризация катода заключается в съеме с него избыточных электронов за счет либо реакции выделения водорода (водородная деполяризация), либо ионизации кислорода (кислородная деполяризация).
Рис. 1. Схемы анодной (а) и катодной (б) поляризации:
1— до поляризации; 2 — в процессе поляризации
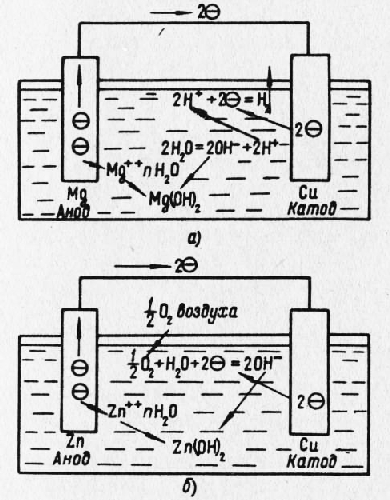
Процесс коррозии с водородной деполяризацией на катоде заключается в использовании водородного иона в качестве деполяризатора. Примером такого процесса является работа гальванической пары, состоящей из магниевого и медного электродов в 3% растворе NaCl. В этой паре магний, имеющий более отрицательный по сравнению с медью потенциал, является анодом и разрушается с выделением газообразного водорода на катоде.
Рис. 2. Схема изменения потенциалов электродов при замыкании внешней цепи:
Ионы магния, перешедшие в раствор с анода, взаимодействуют с ионами гидроксила ОН- и образуют продукт коррозии в виде гидрата окиси магния Mg(OH)2. Коррозия с водородной цеполяризацией на катоде присуща магнию и его сплавам в морской воде, цинку, железу и другим металлам в кислотах.
Рис. 3. Схемы процессов электрохимической коррозии, протекающих с водородной (а) и кислородной (б) деполяризацией на катоде
Ионы цинка, перешедшие в раствор с анода, вступают во взаимодействие с образовавшимися при кислородной деполяризации ионами гидроксила и создают продукт коррозии в виде гидрата окиси цинка Zn(OH)2. Таким образом, интенсивность коррозии с кислородной деполяризацией зависит от количества кислорода, подводимого в единицу времени к поверхности катода. В рассмотренных процессах коррозии с водородной и кислородной деполяризацией на катоде, помимо первичных реакций, протекающих на электродах, во время работы гальванической пары имеют место вторичные реакции, заключающиеся во взаимодействии образовавшихся ионов и в выделении продуктов коррозии. Характер процессов деполяризации на катоде зависит от свойств металла и электролита, определяющих знак и величину потенциала электрода. Водородная деполяризация возможна только в том случае, когда «напор» электронов на катоде имеет достаточную величину, способную обеспечить дегидратацию ионов водорода, соединение их с электронами, образование атомов и молекул водорода и удаление пузырьков его с катода. Этот «напор» обычно оценивают перенапряжением водорода, представляющим собой разность между потенциалом катода при плотности тока, соответствующей началу выделения водорода, и равновесным значениям потенциала при отсутствии тока. По аналогии с водородной деполяризацией на катоде при кислородной деполяризации важное значение для скорости коррозии имеет перенапряжение ионизации кислорода, представляющее собой разность между потенциалом работающего катода и равновесным потенциалом кислорода в том же растворе. Реклама:Читать далее:Примеры электрохимической коррозииСтатьи по теме:Главная → Справочник → Статьи → Блог → Форум |
|
|
|
|
Контакты: Сергей Королёв © 2007-2009 Pereosnastka.ru - информационный сайт о металло- и деревообработке. |
© Все права защищены.
Копирование материалов невозможно. |
|