|
|
Категория:
Производство черных и цветных металлов Далее: Основы металловедения Получение алюминия. По распространенности в природе алюминий занимает первое место среди металлов; его содержание в земной коре составляет 7,45%. В чистом виде алюминий не встречается вследствие своей высокой химической активности, а находится в составе различных соединений, преимущественно окисных. Рудами могут служить лишь такие породы, которые имеют высокое содержание глинозема (А1203) и залегают крупными массами на поверхности земной коры. К таким породам относятся бокситы, нефелины, алуниты и каолины (глины). Важнейшей алюминиевой рудой являются бокситы, состоящие из гидратов окислов алюминия и железа, кремнезема, соединений кальция, магния и др. В последнее время начали применяться также нефелины и алуниты. Крупные месторождения бокситов находятся на Урале, в Тихвинском районе Ленинградской области, в Алтайском и Красноярском краях и в других местах СССР. Нефелин входит в состав апатито-не-фелиновых пород (например, на Кольском полуострове); его состав отвечает формуле (К, Na)20 • А1203 • 2Si02. Технология производства алюминия слагается из двух основных процессов: получение глинозема из руды и получение алюминия из глинозема. Производство глинозема. Способы получения глинозема делятся на три группы: щелочные, кислотные и электротермические. Наибольшее распространение имеет мокрый щелочной способ К. И. Байера, разработанный в России и применяемый для переработки высокосортных бокситов с небольшим количеством (до 5—6%) кремнезема. По этому способу боксит подвергают дроблению, размолу и иногда сушке, затем производят выщелачивание глинозема раствором едкого натра в автоклавах (стальных герметических сосудах) при температуре 250° и давлении 25—30 ат. Автоклавы обогреваются острым паром. Кремнезем, содержащийся в боксите, растворяется в едком натре с образованием силиката натрия (Na2Si03), который взаимодействует с алюминатом натрия, образуя нерастворимый натриевый алюмосиликат, выпадающий в осадок, отделяемый фильтрованием. При этом, чем больше содержание кремнезема в боксите, тем значительнее потери едкого натра и глинозема. Кристаллическая гидроокись, отделенная фильтрованием, тщательно промывается и затем подвергается обезвоживанию (кальцинации) в трубчатых вращающихся печах длиной до 70 м. В этих печах гидроокись алюминия проходит последовательно этапы сушки (при 200°), обезвоживания (950°), прокаливания (1200°) и охлаждения, в результате чего гидратная влага удаляется и получается глинозем (А1203). Раствор после отделения гидроокиси алюминия подвергается регенерации и полученный при этом едкий натр снова используется для выщелачивания новых порций боксита. Для получения одной тонны глинозема расходуется около 2,5 т боксита, до 200 кг едкого натра и до 120 кг извести, применяемой при регенерации едкого натра. Далее алюминат натрия выщелачивают водой, полученный алюми-натный раствор отфильтровывают от остальных соединений и разлагают при нагревании до 80° углекислотой, причем в осадок выделяется гидроокись алюминия, а в растворе образуется сода, которая снова используется для работы. Глинозем из гидроокиси получается путем прокаливания, так же как и при мокром щелочном способе. Для получения глинозема из нефелина применяется спекание нефелина только с известняком, так как в составе нефелина имеются NaaO и К20. В остальном переработка полученного спека подобна рассмотренной выше.
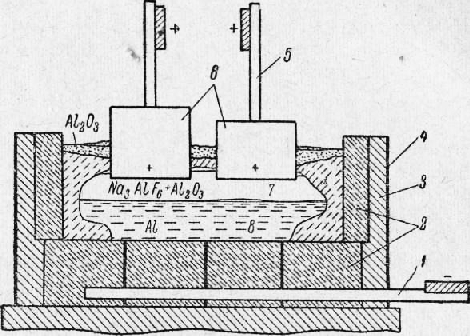
Рис. 1. Схема ванны для электролиза глинозема
Процесс идет при температуре 935—950°. Жидкий алюминий собирается на подине ванны. Расплавленный электролит покрыт сверху застывшей коркой, предохраняющей его от быстрого охлаждения. Потенциал разложения глинозема (1,7 в) меньше, чем криолита (3,7 в), поэтому при прохождении тока через электролит он разлагается; при этом на аноде выделяется кислород, который образует с углеродом СО, а на катоде — алюминий. Убыль глинозема в расплаве пополняется загрузкой новых порций, так что содержание глинозема в электролите поддерживается более или менее постоянным (8—10%). Жидкий алюминий удаляется из ванны сифоном или вакуум-ковшом. Рабочее напряжение ванны 4,3—4,5 в, сила тока 20 000—60 000 а; в настоящее время сооружаются ванны с силой тока до 140 000 а. В ванне на 50 000 а за сутки выделяется около 360 кг алюминия; на получение 1 кг алюминия расходуется 17—19 квт-час электроэнергии и около 2 кг глинозема. Электролитический алюминий подвергается последующему рафинированию переплавкой в электрических печах сопротивления с продувкой хлором или путем дополнительного электролитического процесса, при котором анодом является исходный жидкий алюминий, а катодом — рафинированный алюминий, тоже в жидком состоянии. К исходному жидкому алюминию добавляют 25% меди, чтобы увеличить его удельный вес до 3,5. Поверх слоя алюминия располагают слой жидких хлористых и фтористых солей, служащий электролитом (уд. вес 2,7). Выше электролита выделяется около угольных катодов слой рафинированного алюминия высокой чистоты. Процесс ведут при 800°. Посредством дополнительного электролитического рафинирования .удается довести в отдельных случаях чистоту алюминия до 99,999%. Технический алюминий содержит от 98 до 99,9% А1. По семилетнему плану (1959—1965 гг.) производство алюминия в нашей стране увеличивается в 2,8 раза. Получение магния. В чистом виде магний в природе не встречается вследствие своей высокой химической активности. В виде соединений магний широко распространен в природе: он составляет 2,35% от веса земной коры, причем находится не только в твердых породах, но также в морской воде и в воде соленых озер. В качестве руд для производства магния обычно используют магнезит, содержащий преимущественно карбонат магния (MgC03), доломит с преимущественным содержанием двойного карбоната магния и кальция (MgC03 • СаС03), карналлит, содержащий двойной хлорид магния и калия (MgCl2 • КС1 • 6Н20), и бишофит — шестиводный хлорид магния (MgCI2 • 6Н20), получаемый из морской воды и воды некоторых озер путем испарения и кристаллизации. В Советском Союзе наибольшее промышленное значение имеют следующие месторождения магниевых руд: магнезита — Саткинское на южном Урале и Халиловское в Оренбургской области; доломита — Жигулевское, Никитовское в Донбассе, Щелковское и Подольское в Московской области и др.; карналлита — Соликамское на Урале; бишофита — озера Сакское и Сасык-Сивашское в Крыму. Существуют электролитический и термические способы получения магния. Электролитический способ получения магния. По этому способу сначала получают безводный хлорид магния (MgCl2), который затем подвергают электролизу с целью получения магния. Получение хлорида магния из бишофита и карналлита производится путем их обезвоживания при медленном нагреве в трубчатых печах (100—180°).‘Получение хлорида магния из каустического магнезита производится путем обработки его при температуре 800—900° газообразным хлором в присутствии углерода в электрической шахт-ной печи: MgO + Cl, + C = MgCl.2 + CO. Электролиз хЛорида магния производят в плотно закрытых электролитических ваннах (рис. 2).
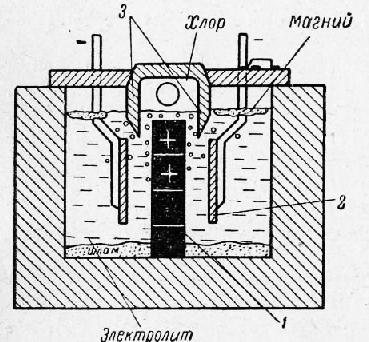
Рис. 2. Схема магниевого электролизера:
1 — графитовые аноды; 2 — стальные катоды; 3 — огнеупорная перегородка
Аноды изготовляют из графита, катоды — из стали в форме пластин; те и другие расположены в ванне вертикально и параллельно друг другу. При электролизе на анодах выделяется газообразный хлор, который пузырьками всплывает на поверхность и по хлоропроводам отводится для дальнейшего использования; около катодов выделяется жидкий магний. Удельный вес электролита увеличивается добавкой в него СаС12 так, чтобы он превышал удельный вес магния, поэтому последний всплывает на поверхность электролита, откуда по мере накопления извлекается с помощью вакуумных ковшей. С целью предупреждения взаимодействия хлора с магнием рабочее пространство ванны разделяют на анодное и катодное с помощью огнеупорных перегородок, устанавливаемых между анодами и катодами. Расход электроэнергии на тонну магния составляет 15 000—17 000 квт-ч. Рафинирование электролитического магния производится или переплавкой его вместе с рафинирующими флюсами (смесь хлористых солей щелочных и щелочно-земельных металлов) или возгонкой в вакууме (0,1—0,2 мм рт. ст.) при температуре 600°. Таким способом получают магний очень высокой чистоты (99,99% Mg). Термические способы получения магния. За последние годы термические способы производства магния получили широкое распространение вследствие своей простоты. Сущность термических способов состоит в восстановлении окиси магния нефтяным коксом в герметичной дуговой печи при температуре 1900—2000°. Испаряющийся магний быстро охлаждается до 200°, собирается, очищается путем дистилляции и переплавляется. Таким способом получается чистый магний (99,97% Mg) при расходе электроэнергии около 21 000 квт-ч на тонну металла. В качестве восстановителя может быть применен также кремний при температуре 1160° и остаточном давлении (при вакууме) около 0,05 мм рт. ст. Производство титана. Титан обладает высокой прочностью (вдвое прочнее железа), высокой стойкостью в разъедающих средах и небольшим удельным весом (4,5 г/см3), поэтому он является весьма ценным конструкционным металлом. Титан широко используется в самолетостроении, химической и других отраслях промышленности. Рудами для получения титана являются рутил (содержащий ТЮ2) и ильменит (содержащий FeTi03). Основным источником ильменита являются титано-магнетитовые руды (смесь ильменита и магнетита — Fe304). Такие руды подвергаются обогащению (мокрому или электромагнитному), в результате которого получаются титановые концентраты. Извлечение титана из руд — трудная задача, так как он при нагреве реагируете кислородом и азотом воздуха, а в расплавленном состоянии и со всеми известными огнеупорами. Металлургия титана включает следующие процессы: Реклама:Читать далее:Основы металловеденияСтатьи по теме:Главная → Справочник → Статьи → Блог → Форум |
|
|
|
|
Контакты: Сергей Королёв © 2007-2009 Pereosnastka.ru - информационный сайт о металло- и деревообработке. |
© Все права защищены.
Копирование материалов невозможно. |
|