|
|
Категория:
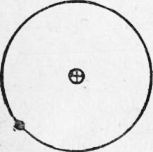
Технология металлов Для того чтобы понять внутреннее строение металла, необходимо вспомнить, что представляют собой мельчайшие частицы, образующие все вещества, — атомы. Строение атома. Атом состоит из положительного заряженного ядра, окруженного отрицательно заряженными частичками, называемыми электронами, движущимися вокруг ядра с огромной скоростью (наименьшей скоростью обладает электрон водорода, движущийся со скоростью 2000 км/сек). На рис. 1 приводится схема строения атома водорода. Вокруг ядра простейшего атома — водорода, занимающего первое место в периодической таблице, вращается по орбите только один электрон.
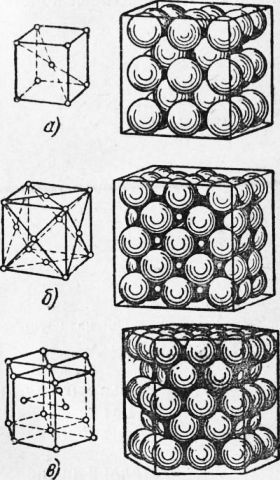
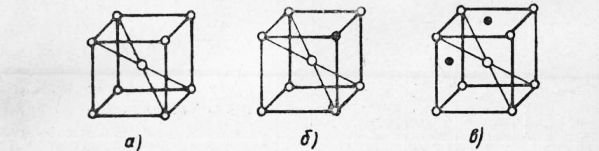
Рис. 1. Схема строения атома водорода Строение чистых металлов. Металл состоит из положительно.заряженных ионов и «свободных» электронов. Положительный «он представляет собой атом, потерявший один или несколько электронов. Эти электроны называют свободными электронами. Они постоянно переходят от одних ионов к другим и вращаются вокруг ядра то одного, то другого иона. В металлах положительно заряженные ионы расположены в строго определенном порядке, образуя так называемую пространственную кристаллическую решетку. Наряду с этим есть тела, называемые аморфными, где атомы располагаются хаотично. В связи с этим все твердые тела делятся на тела кристаллические и аморфные. К кристаллическим телам можно отнести металлы, поваренную соль, сахар и др. Примером аморфных тел могут служить стекло, пластмасса, смола, клей и др. Наличие свободных электронов во всех металлах обусловливает существование общих металлических свойств. К ним следует отнести прочность, высокую электропроводность и теплопроводность. Кристаллические решетки у металлов могут быть различных типов. Наиболее распространены изображенные на рис. 3 типы решеток:
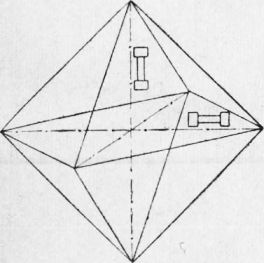
Рис. 2. Различные типы кристаллических решеток: Кристаллические тела и их особенности. Кристаллические тела обладают различными свойствами в различных направлениях. Это явление, называемое анизотропией, объясняется тем, что в кристаллических решетках расстояние между атомами (ионами), а следовательно, и взаимодействие их между собой в различных направлениях неодинаковы; свойства металлов определяются взаимодействием атомов (ионов). Если взять одиночный кристалл меди (или, как его называют, монокристалл) и вырезать из него образцы в различных направлениях, то свойства таких образцов будут различны. Прочность может изменяться в 2—2,5 раза, пластичность, т. е. способность деформироваться, — в 5—6 раз, в зависимости от направления, в котором был вырезан образец.
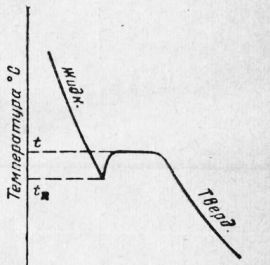
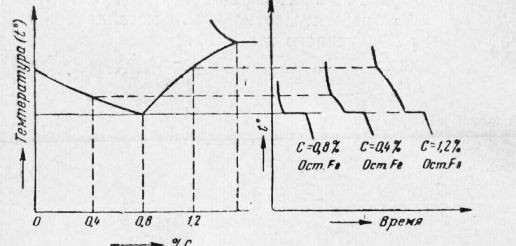
Рис. 3. Монокристалл, из которого вырезаны образцы Однако такое различие свойств наблюдается только у монокристаллов. Монокристаллы больших размеров получают искусственным путем. В естественных условиях металлы являются телами поликристаллическим и, т. е. они состоят из большого числа по-разному ориентированных мелких кристалликов. Обычно размер каждого мелкого кристаллика определяется долями миллиметра. Каждый кристаллик расположен по-своему, но свойства по всем направлениям оказываются примерно равными. Другой особенностью кристаллов является существование вполне определенных плоскостей — плоскостей скольжения (спайности), по которым происходит перемещение атомов (ионов) кристаллической решетки при механическом воздействии. Очень хорошо плоскости спайности выявляются у кристаллов слюды, которая расщепляется по этим плоскостям. Важным свойством чистых металлов как кристаллических тел является наличие определенной температуры плавления. Аморфные тела переходят в жидкое состояние постепенно, размягчаясь при изменяющейся температуре, а кристаллические — при постоянной температуре. Процесс кристаллизации. Кристаллизацией называется процесс образования кристаллов. Если кристаллы образуются из жидкости, то процесс называется первичной кристаллизацией. Для изучения процесса кристаллизации строят кривые охлаждения, т. е. кривые, показывающие изменение температуры с течением времени при охлаждении расплавленного металла. Для построения кривой охлаждения необходимо иметь прибор для измерения температуры и часы или секундомер. В качестве прибора для измерения температуры используют термометр либо термоэлектрический пирометр. При охлаждении металла через равные промежутки времени производится измерение температуры. По результатам такого измерения строят кривые охлаждения. Для чистого металла кривая охлаждения имеет такой вид, как указано на рис. 5. Кривая показывает, что при охлаждении металла как в жидком, так и в твердом состоянии температура понижается равномерно. Процесс кристаллизации протекает при одной и той же температуре, которая на рис. 5 обозначена буквой t. Металл, охладившись до температуры t, не будет еще кристаллизоваться, а останется в жидком состоянии вплоть до температуры tn. Та— ким образом, металл переохладится. Чем больше скорость охлаждения, тем больше и степень переохлаждения. Кристаллизация сопровождается выделением тепла, что поднимает температуру металла до t и поддерживает затем ее постоянной до полного затвердевания. Температуру t, при которой в металле происходит превращение из жидкого состояния в твердое, называют критической температурой, или- критической точкой плавления. Жидкое состояние металла характеризуется большой подвижностью атомов. По мере приближения металла к температуре затвердевания атомы его в отдельных местах начинают группироваться так же, как в кристаллических решетках твердого металла. Некоторые из этих атомно-кристаллических групп могут стать зародышами будущих кристаллов, или, как говорят, центрами кристаллизации. Дальнейший рост кристаллов происходит путем постепенного наращивания на эти центры новых атомных слоев. Таким образом, процесс кристаллизации заключается в образовании центров кристаллизации и в их последующем росте. На рис. 6 показана схема развития процесса кристаллизации. В первые моменты кристаллы растут свободно, сохраняя свою кристаллическую форму. По мере развития процесса кристаллы встречаются друг с другом, препятствуя тем самым дальнейшему росту в этом направлении. Кристаллы будут расти только лишь в некоторых направлениях, где имеется еще жидкий металл. Благодаря этому правильная форма кристалла теряется и он приобретает округлую форму. Такие кристаллы называют зернами.
Рис. 4. Кривая охлаждения чистого металла При быстром и неравномерном охлаждении зерна принимают вытянутую форму. Такую структуру можно наблюдать в сварном шве меди.
Рис. 5. Схема развития процесса первичной кристаллизации
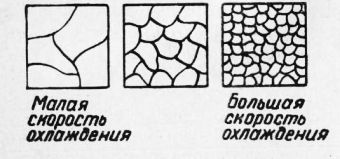
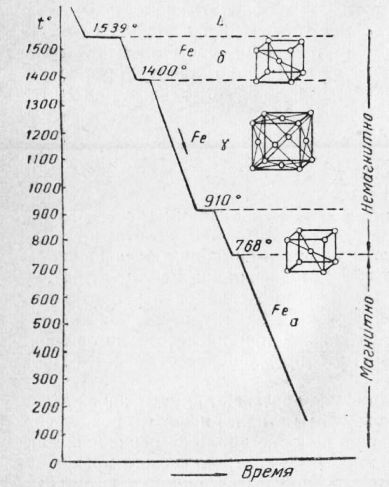
Рис. 6. Зависимость размеров зерен металла от скорости охлаждения Размер зерна при первичной кристаллизации зависит от многих причин: температуры нагрева жидкого металла и времени выдержки при ней, температуры заливки в форму, способа заливки металла, способа охлаждения и др. Теория кристаллизации показывает, что число образующихся зерен и размер их определяются: числом центров кристаллизации, самопроизвольно возникающих в жидкости в момент начала затвердевания, и скоростью роста каждого кристалла. Обе эти величины зависят от скорости охлаждения металла в процессе кристаллизации. На рис. 6 схематично изображена зависимость размеров зерен от скорости охлаждения. В настоящее время в производстве черных и цветных металлов получил широкое распространение процесс искусственного изменения размеров и формы зерен путем введения в расплавленный металл нерастворимых веществ, называемый модифицированием. Эти вещества распределяются равномерно по всему объему металла и образуют дополнительные центры кристаллизации, благодаря чему зерна металла получаются более мелкими и могут изменять свою форму. Такими веществами могут быть порошок окиси алюминия при модифицировании стали, сплавы железа с хромом и железа с кремнием, а также чистый магний при модифицировании чугуна, натрий при модифицировании силумина (алюминиевый сплав) и др. Свойства сплавов и металлов в сильной степени зависят от размеров и формы зерен. Металлы и сплавы с мелкозернистым строением обладают более высокой прочностью, особенно ударной прочностью, твердостью, лучшей обрабатываемостью. Изменение структуры и свойств металлов в твердом состоянии. Некоторые металлы имеют в твердом состоянии несколько видов кристаллической решетки. Достаточно такие металлы нагреть до определенной температуры, как атомы перестраиваются и образуют новую кристаллическую решетку. Процесс перехода из одного типа кристаллического строения в другой называется аллотропическим превращением. Различные типы кристаллического строения называют аллотропической формой, или модификацией. Аллотропические превращения, так же как и первичная кристаллизация, протекают при постоянной температуре, так как при охлаждении происходит выделение, а при нагреве — поглощение тепла. На кривой охлаждения это превращение отмечается горизонтальным участком. Аллотропические превращения протекают путем зарождения центров кристаллизации в твердом металле и роста вокруг них кристаллов новой модификации,, подобно процессу первичной кристаллизации. В связи с этим процесс аллотропического превращения, связанный с перекристаллизацией (повторной кристаллизацией) в твердом состоянии, называют вторичной кристаллизацией. Наиболее известными и имеющими практическое применение являются аллотропические превращения железа, олова, марганца, кобальта. Превращения в железе. На кривой охлаждения железа, приведенной на рис. 7, показаны аллотропические превращения, претерпеваемые железом при очень медленном охлаждении. При охлаждении железо затвердевает при температуре 1539°. При этом образуется Fes, т. е. железо с «объемноцентрирован-ной решеткой». При последующем охлаждении при температуре 1400° Fes превращается в Fet> т. е. в железо с «гранецентрированной решеткой». При температуре 910° Fe., превращается в F*, т. е. в железо с «объемноцентрированной решеткой». Остановка на кривой охлаждения, имеющая место при 768°, не связана с перестройкой кристаллической решетки, а вызывается изменением магнитных свойств. Ниже этой температуры железо магнитно, выше — немагнитно (немагнитное железо иногда обозначается Fep)’. Превращения олова. Олово существует в двух модификациях: Sn« и Snp. Олово a (Srio) называют серым оловом. Оно представляет собой порошок. Олово р (Snrp) — белое олово, прочный металл. Превращение белого олова в серое протекает при температуре + 18°, но с наибольшей скоростью этот процесс протекает при переохлаждении до минус 30°. На изделиях из белого олова после длительного хранения на холоде возникают бугорки серого олова, которые затем рассыпаются в порошок. Это явление получило название оловянная чума. Наиболее опасна «оловянная чума» при хранении олова в зимнее время в холодном помещении. Одновременно с изменением кристаллической решетки металла при аллотропическом превращении происходит изменение формы и величины зерна. В практике термической обработки этим часто пользуются. Наблюдать процесс вторичной кристаллизации невооруженным глазом нельзя. Внешний вид металла при вторичной кристаллизации не изменяется. Ее можно обнаружить либо по изменению свойств металла или сплава (температура, прочность, твердость, электросопротивление и т. д.), либо наблюдая металл под микроскопом. Пластическая деформация и рекристаллизация. Изменить величину и форму зерен можно также и механическим воздействием, например ковкой, штамповкой, прокаткой, волочением и т. д., т. е. путем изменения формы изделия (или, как говорят, путем пластической деформации металла) с последующим нагревом, после которого можно получить зерна разных размеров.
Рис. 7. Кривая охлаждения железа Пластическая деформация протекает путем смещения (сдвигов) тонких слоев металла (пачек) в кристалле относительно друг друга по плоскостям скольжения под влиянием механических усилий. Металл в результате пластической деформации становится более прочным (упрочняется).
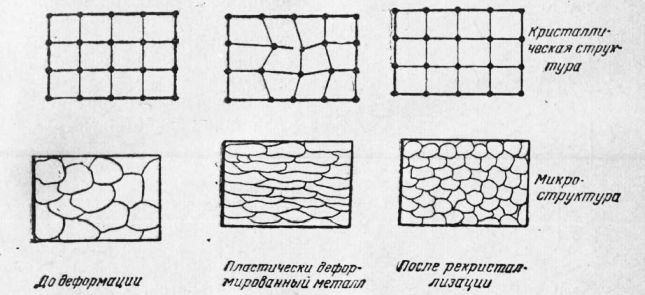
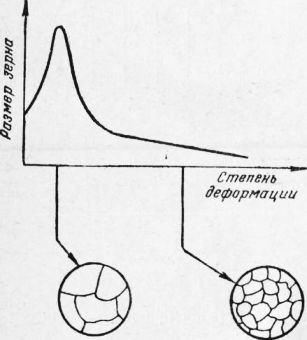
Рис. 8. Схема изменения структуры металла при деформации и рекристаллизации Упрочнение металла в процессе пластической деформации называют наклепом. Этим явлением часто пользуются для повышения прочности детали или конструкции (обдувка дробью, обкатка роликом и т. д.). В результате пластического деформирования зерна размельчаются, принимают вытянутую форму, напоминающую по виду волокна. Такое строение металла обладает большим различием свойств в разных направлениях и не является устойчивым. При нагреве пластически деформированного металла строение его восстанавливается. Возникают новые зерна с недеформированной кристаллической решеткой. Этот процесс называют рекристаллизацией. Температуру, при которой начинают возникать новые зерна с недеформированной решеткой, называют температурой рекристаллизации. Эта температура устанавливается экспериментально по изменению различных свойств металла (прочности, пластичности, плотности, электросопротивления и т. д.). На рис. 9 схематически показаны изменения в строении металла в результате пластической деформации и рекристаллизации, Искаженность кристаллической решетки в процессе пластической деформации можно обнаружить с помощью рентгеноструктурного анализа, о котором будет сказано ниже. Деформацию зерен и размельчение их после рекристаллизации можно наблюдать под микроскопом, а для некоторых металлов (олово) непосредственно невооруженным глазом. Как видно из рисунка, при рекристаллизации кристаллическая структура восстанавливается и деформированные зерна еновь приобретают округлую форму. Процесс пластической деформации может идти одновременно с процессом рекристаллизации, если деформация происходит при температуре выше температуры рекристаллизации. В связи с этим различают два вида обработки металлов давлением. Холодной обработкой металлов давлением называют обработку, которую ведут при температуре ниже температуры рекристаллизации. При такой обработке металл наклёпывается. Горячей обработкой металлов давлением называют обработку, которую ведут при температуре выше температуры рекристаллизации. При такой обработке пластически деформированный металл рекристаллизуется в процессе обработки давлением. Размер получающихся новых зерен зависит от степени пластической деформации, сообщенной металлу, и от температуры нагрева, при которой идет процесс рекристаллизации. Чем выше температура нагрева, тем больше размер образующихся новых зерен. Влияние степени пластической деформации схематически представлено на рис. 9. Вначале с увеличением степени деформации размер зерна при рекристаллизации сильно возрастает, затем с дальнейшим увеличением степени деформации уменьшается. Степень деформации, дающая максимальный размер зерна при нагреве, называется критической. При ковке, прокатке и других видах обработки нужно следить за тем, чтобы металл не приобретал критической степени деформации, иначе при последующем нагреве получается крупнозернистый металл с плохими свойствами.
Рис. 9. Изменение величины зерна в зависимости от степени пластической деформации Строение сплавов. Металлическими сплавами, как уже указывалось, называются сложные материалы, полученные путем сплавления одного металла с другими металлами или неметаллами. При сплавлении металлы и неметаллы взаимодействуют между собой и образуют либо химические соединения, либо твердые растворы, либо, что очень редко, остаются в химически чистом виде. Химические соединения характерны тем, что атомы элементов, образующих сплав, объединяются в определенном количестве. Состав соединения может быть выражен химической формулой. Твердые растворы характеризуются тем, что в атомно-кристаллическую решетку основного металла — растворителя входят атомы растворенного вещества.
Рис. 10. Кристаллические решетки: Атомы растворенного вещества могут либо замещать атомы растворителя, образуя так называемый твердый раствор замещения, либо внедряться в решетку растворителя, образуя твердый раствор внедрения. Решетки таких твердых растворов в виде схемы показаны на рис. 10. В результате вновь образовавшийся сплав может состоять либо только из химического соединения, либо только из твердого раствора. В этих случаях сплав называют однородным. Чаще всего сплавы состоят частично из химического соединения и частично из твердого раствора. В этих случаях сплав будет уже неоднородным. Его строение (структура) будет характеризоваться механической смесью из химического соединения и твердого раствора. Сплав можно получить из двух элементов. В этом случае его называют двойны м. Если сплав получен из нескольких элементов, его называют соответственно тройным, четвертным и т. д. С целью облегчения изучения сплавов их объединяют в системы сплавов. К данной системе относят все сплавы, которые могут образовать два или несколько элементов, различающихся между собой лишь количеством элементов, образующих сплав, т. е. концентрацией этих элементов. Так, например, все стали и чугуны являются сплавами системы железа и углерода, но различаются между собой количеством этих элементов. Для изучения сплавов выбранной системы строят диаграмму состояния, по которой определяют структурные превращения и связанные с ними изменения свойств при нагреве и охлаждении, температуры горячей обработки металлов давлением, режимы термической обработки и др. Построение диаграммы состояний. Если сплав получен из двух металлов, то диаграмма состояний имеет два измерения. На одной оси — вертикальной — откладывают температуры, при которых сплав изменяет свое строение. Эти температуры называются критическими температурами, или критическими точками. На второй оси — горизонтальной—откладываются концентрации сплавов, т. е. содержание элементов, составляющих сплав, выраженное чаще всего в весовых процентах.
Рис. 11. Построение диаграммы Fe—С На координатную сетку наносятся значения всех критических точек, определенных по кривым охлаждения, построенным опытным путем. Затем все критические точки сплавов данной системы соединяют, в результате чего образуются линии диаграммы состояний. Кривые охлаждения для сплавов строятся таким же образом, как для чистых металлов. Пример построения диаграммы железо — углерод показан на рис. 11. Реклама:Читать далее:Методы изучения структуры металлов и сплавовСтатьи по теме:Главная → Справочник → Статьи → Блог → Форум |
|
|
|
|
Контакты: Сергей Королёв © 2007-2009 Pereosnastka.ru - информационный сайт о металло- и деревообработке. |
© Все права защищены.
Копирование материалов невозможно. |
|